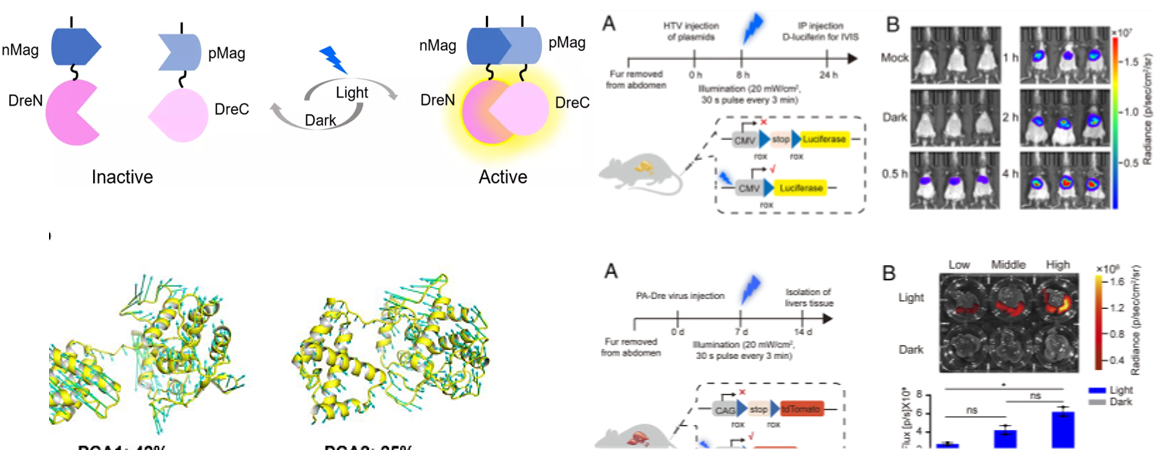
在动物体内特定的细胞群体中进行时空特异性的细胞标记和基因操作一直是生物学研究的技术难题。位点特异性重组酶,尤其是基于Cre重组酶而开发的各种诱导型重组酶系统被广泛用于细胞标记和基因功能研究。其中光诱导的Cre重组酶系统不仅安全、易调节且具有高度的时空分辨率。然而单个重组酶系统具有一定的局限性,很难用于解析复杂的细胞网络,尤其是神经系统。本文旨在构建光激活的Dre重组酶(photoactivatable Dre,PA-Dre)系统及Cre激活的光诱导Dre(Cre-Activated Light Inducible Dre,CALID)系统并在小鼠体内和脑内特定的细胞群体中实现时空特异性的基因调控。
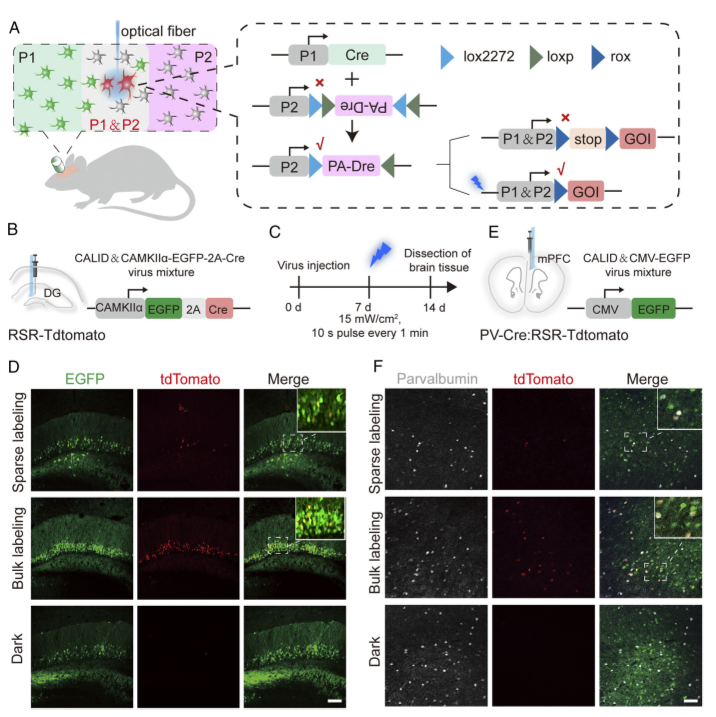
研究将蛋白质动态构象理论计算与光遗传学相结合,开发出了高效、严格受蓝光调控的光激活Dre重组酶系统(photoactivatable Dre,PA-Dre)并结合组织特异性Cre构建了由蓝光和Cre双调控的新型光诱导Dre重组酶系统,命名为Cre激活的光诱导Dre(CALID)系统,该系统不仅能在细胞上高效严谨地调控基因表达,还可在小鼠的肝脏和脑部灵活地调控内源基因的表达。
我们相信已有的Cre转基因小鼠与光诱导Dre重组酶系统结合将有助于阐明各研究领域中复杂的生物学问题,为基因编辑领域增加了新工具,为其后续研究开辟新途径。该论文在2020年12月14日在《PNAS》杂志上发表(DOI: https://doi.org/10.1073/pnas.2003991117)。